Commentaire d’article
Identification of an Immune-specific Class of hepatocellular carcinoma based on molecular features (Sia D et al. Gastroenterology 2017)
Le carcinome hépatocellulaire (CHC) est la deuxième cause de décès par cancer dans le monde (Globocan 2012), de mauvais pronostic avec un rapport mortalité/incidence à 0,95. Malgré une meilleure connaissance des altérations moléculaires impliquées dans les processus de carcinogenèse, les options thérapeutiques pour le CHC avancé restent limitées à l’utilisation des inhibiteurs de kinases multiples (Sorafenib et Regorafenib).
L’immunothérapie basée sur les inhibiteurs des points de contrôle immunitaires (PCI) est susceptible de booster ou de réveiller les réponses cellulaires T anti-tumorales. Elle connait actuellement un réel succès dans le traitement de certaines tumeurs solides non résécables ou à un stade métastatique, notamment les carcinomes d’origine pulmonaire et mélanique, et plus récemment ORL, urothéliale et les lymphomes Hodgkiniens. Quatre médicaments sont approuvés par la FDA, dirigés contre CTLA-4 (Ipilimumab), PD-1 (Nivolumab, Pembrolizumab) et PD-L1 (Atezolimumab). Cependant, tous les patients ne bénéficient pas d’une amélioration ou d’une stabilisation tumorale, et seuls les carcinomes pulmonaires bénéficient d’un immunomarquage théranostique visant à déterminer le pourcentage de cellules tumorales exprimant PD-L1, prédictif de la réponse thérapeutique (1). L’essai clinique CheckMate 040 réalisé dans le CHC avancé (Nivolumab en première ligne ou après échec du Sorafenib dans des CHC d’étiologies variées) a montré une réponse objective dans 20% des cas et une stabilisation tumorale dans 45%, sans lien avec l’expression de PD-L1 dans les cellules tumorales (2). Cette étude a conduit la FDA à approuver l’utilisation du Nivolumab (Optivo®) en deuxième ligne dans le traitement du CHC avancé résistant au Sorafenib (3).
Un intérêt croissant est porté au micro-environnement tumoral, et notamment à la présence et à la nature de l’infiltrat immunitaire intra et péri-tumoral, qui pourrait également déterminer la réponse thérapeutique. Ainsi, un infiltrat inflammatoire tumoral riche en cellules T, un environnement cytokinique IFN-médié, une expression élevée de PD-1 et PD-L1, et une charge mutationnelle élevée apparaissent comme des facteurs prédictifs de bonne réponse aux inhibiteurs de PCI.
La classification moléculaire des CHC établie ces dernières années (4,5) démontre bien qu’il s’agit d’un groupe hétérogène de tumeurs, aux étiologies et aux aspects morphologiques variés, mais dont les correspondances phénotypiques/génotypiques sont étroites (6). De manière intéressante, comme cela a été décrit pour le mélanome, le groupe des CHC présentant des mutations CTNNB1 activatrices de la voie β-caténine serait caractérisé par une exclusion des cellules immunitaires T du stroma tumoral, ce qui pourrait les rendre résistantes à l’immunothérapie par inhibiteurs de PCI (7).
L’objectif principal de cette étude, conduite par l’équipe de Llovet sur presque un millier de CHC, est d’établir les caractéristiques moléculaires de l’infiltrat inflammatoire intra et péri-tumoral des CHC, dans le but de mieux cibler les CHC riches en cellules immunitaires exprimant les PCI et de personnaliser le traitement (8). L’étude comporte une cohorte test (228 CHC congelés) et plusieurs cohortes indépendantes de validation (728 CHC, congelés ou fixés en formol et inclus en paraffine). Les profils d’expression des gènes ont été établis dans les cellules tumorales et dans le stroma tumoral. La clusterisation des données issues de l’analyse de l’expression des gènes et de méthylation de l’ADN a bénéficié d’une méthode bioinformatique en analyse multivariée (Non-negative Matrix Factorization) basée sur des groupes d’algorithmes. Les résultats ont été corrélés à la caractérisation du microenvironnement inflammatoire en histologie et en immunohistochimie et à la classification moléculaire des CHC.
Cette méthode a permis d’individualiser une « Classe Immune », nouveau sous-groupe moléculaire représentant 24 % des CHC, significativement enrichi en signatures inflammatoires identifiant la présence de cellules immunitaires cytotoxiques, notamment T et Natural Killer et de leurs molécules chimio-attractives (CCL5, CXCL9, CXCL10), de structures lymphoïdes tertiaires (SLT), de macrophages, de PD-1, d’IFN-α et IFN-γ, et deux signatures prédictives de bonne réponse au Pembrolizumab identifiées dans le mélanome et les carcinomes malpighiens de la tête et du cou. Ces CHC arboraient histologiquement un stroma tumoral plus inflammatoire et un nombre de SLT significativement plus élevé ainsi qu’une expression immunohistochimique PD-1 et PD-L1 plus élevée que les autres CHC.
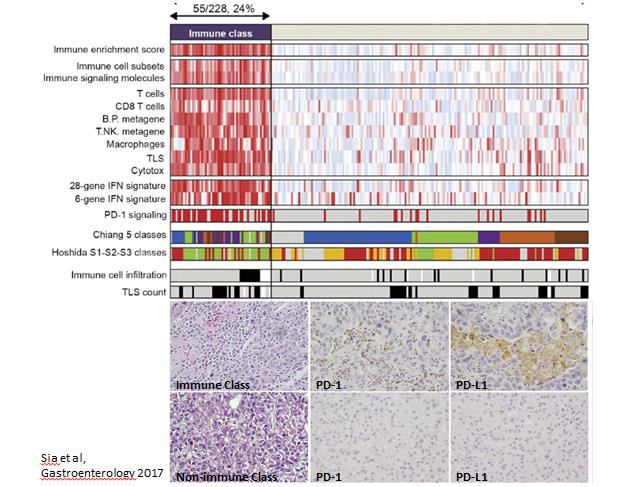
Au sein de cette « Classe Immune », l’étude du microenvironnement immunitaire montrait que 67% des CHC présentait des signatures moléculaires traduisant une réponse immunitaire active, riche en cellules T CD8, IFN-γ, granzyme B ; c’est dans cette catégorie qu’étaient retrouvées les signatures IFN prédictives de bonne réponse aux inhibiteurs de PCI. Les autres CHC (33%) présentaient des signatures moléculaires caractérisant une réponse immunitaire épuisée, avec un stroma inflammatoire immunosuppressif riche en TGF-β et en macrophages M2. Ce sous-type de CHC immunitairement fatigués présentait un phénotype agressif, avec un enrichissement significatif des voies de signalisations impliquées dans les processus de récidive et de métastase tumorale, de transition épithélio-mésenchymateuse et d’angiogenèse, alors que le risque de récidive tumorale après exérèse chirurgicale était significativement plus faible dans le sous-type de CHC immunitairement actifs. Par contre, la densité de cellules inflammatoires et de SLT à l’histologie, et l’expression immunohistochimique de PD-1/PD-L1 n’étaient pas différentes entre les deux profils immunologiques.
Cette « Classe Immune » était identifiée de manière très robuste sur toutes les cohortes testées en congélation et en paraffine (22 à 37% des CHC). Elle présentait moins d’anomalies chromosomiques que le reste des CHC mais aucune différence significative n’était notée dans le nombre de néoantigènes et la charge mutationnelle des cellules tumorales. De manière intéressante, la corrélation avec les classes moléculaires connues de CHC montrait une exclusion des CHC mutés CTNNB1.
En conclusion : l’identification de cette « Classe Immune de CHC » semble prometteuse pour le succès de l’immunothérapie par inhibiteurs de CPI. La réalisation de biopsies hépatiques dirigées pourrait d’une part permettre de détecter les CHC au stroma particulièrement inflammatoire et/ou exprimant fortement PD-1 et/ou PD-L1 afin de maximiser les chances de réponse au traitement, et d’autre part, d’isoler les CHC mutés β-caténine. D’autres études sont nécessaires pour valider l’intérêt (1)- du ciblage de ces deux classes moléculaires et (2)- du screening histologique et/ou d’un testing immunohistochimique.
Références bibliographiques
1/ Herbst RS, Bass P, Kim DW, et al. Pembrolizumab versus Docetaxel for previously treated, PD-L1-positive, advanced non-small cell lung cancer (KEYNOTE-010): a randomized controlled trial. Lancet 2016 ; 387:1540-1550.
2/ El-Khoueiry AB, Sangro B, Yau T, et al. Nivolumab in patients with advanced hepatocellular carcinoma (CheckMate 040): an open-labed, non comparative, phase 1 / 2 dose escalation and expansion trial. Lancet 2017.
3/ Nivolumab approved for liver cancer. Cancer Discov 2017 ; Nov;7(11):OF3. doi: 10.1158/2159-8290.CD-NB2017-138. Epub 2017 Oct 4.
4/ Zucman-Rossi J, Villanueva A, Nault JC, et al. Genetic Landscape and biomarkers of hepatocellular carcinoma. Gastroenterology 2015 ; 149 :1226-1239
5/ Llovet JM, Zucman-Rossi J, Pikarsky E, et al. Hepatocellular carcinoma. Nat Rev Dis Primers 2016 ; 2:16018.
6/ Calderaro J, Rousseau B, Amaddeo G, et al. Programmed death ligand 1 expression in hepatocellular carcinoma: relationship with clinical and pathological features. Hepatology 2016 ; 64 :2038-2046.
7/ Spranger S, Bao R, Gajewski TF, et al. Melanoma-intrinsic beta-catenin signaling prevents anti-tumor immunity. Nature 2015 ; 523:231-235.
8/ Sia D, Jiao Y, Martinez-Quetglas I, et al. Identification of an immune-specific class of hepatocellular carcinoma based on molecular features. Gastroenterology 2017 ; 153 :812-826.

