Commentaire d’article
Characterization of liver injury induced by cancer immunotherapy using immune checkpoint inhibitors. E de Martin, JM Michot, B Papouin et al. J Hepatol 2018 : 1181-119
L’immunothérapie connait un essor dans le traitement des tumeurs métastatiques. Ce succès thérapeutique récent est basé sur l’utilisation d’anticorps monoclonaux bloquant les points de contrôle immunitaires (PCI) qui freinent la réponse cellulaire T. Le but est de réveiller l’immunité anti-tumorale notamment lymphocytaire T cytotoxique et de diminuer la tolérance vis-à-vis de la cellule cancéreuse. Les principaux anticorps utilisés sont des anti-CTLA4 (Ipilimumab), anti PD-1 (Pembrolizumab, Nivolumab) et anti-PD-L1 (Durvalumab).
En effet, durant le développement du cancer comme lors d’une exposition chronique à un pathogène, le système immunitaire se fatigue et devient « tolérant » envers les cellules tumorales reconnues comme une partie du soi. Cette tolérance est permise via l’activation d’un réseau de PCI présents sur les cellules tumorales et dans le micro-environnement inflammatoire tumoral, permettant leur échappement et leur survie.
Le foie est un organe particulièrement immunotolérant, du fait de son exposition continue à un afflux d’antigènes exogènes d’origine microbienne ou alimentaire provenant du système porte, en contact permanent avec les cellules immunitaires intra-hépatiques. Cette tolérance est aussi médiée par l’activation des PCI régulant à la baisse les fonctions immunitaires afin d’éviter une lyse permanente des hépatocytes.
La crainte suscitée par l’utilisation de ces nouvelles immunothérapies inhibitrices de PCI, est de modifier l’équilibre du système immunitaire, notamment celui intra-hépatique, et d’induire des réactions cytotoxiques immuno-médiées à l’origine de lésions tissulaires d’autant plus marquées que des combinaisons thérapeutiques seront développées. Ainsi, l’incidence des hépatites aigues serait évaluée, quel que soit leur niveau de gravité, autour de 1-5% et 4-9% pour les anti-PD-1 et anti-CTLA4, respectivement, et jusqu’à 18% en association (Zarrabi 2018 ; Larkin 2015).
L’étude observationnelle présentée par l’équipe de Paul BROUSSE (de Martin 2018) est basée sur le registre national de pharmacovigilance REISAMIC créé en 2013 afin de collecter les effets indésirables liés à l’utilisation de ces immunothérapies. Sur une période de deux ans (2015-2017) incluant 536 patients, 16 (3,5 %) ont présenté une hépatite aigue de grade ≥ 3 selon la terminologie NCI-CTCAE (ASAT/ALAT et/ou GGT/PAL > 5N, bilirubine totale > 3N). Le diagnostic de DILI (Drug Induced Liver Injury) étant un diagnostic d’exclusion, la toxicité à l’immunothérapie était retenue selon le score d’imputabilité RUCAM (DILI hautement probable : 14 et DILI probable : 2) suite à l’utilisation simple (n=12) ou combinée (n=4) d’anti-PD-1/PD-L1 (n=9) et/ou anti-CTLA4 (n=7), alors que toutes les autres causes d’hépatite aigue étaient écartées.
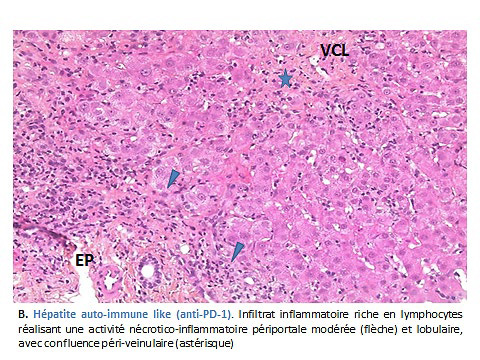
Cette étude décrit également les lésions histologiques des 16 biopsies hépatiques, correspondant à une hépatite aigue d’intensité variable à prédominance cytolytique, avec composante cholestatique discrète dans la moitié des cas. A cet aspect général peu spécifique, s’associent deux patterns lésionnels plus évocateurs du médicament utilisé (A) pour anti-CTLA4, une hépatite granulomateuse à cellules épithélioïdes avec dans la moitié des cas un anneau de fibrine, aspect déjà rapporté avec Ipilimumab (Ribas 2013 ; Spengler 2017) et (B) pour anti-PD-1/PD-L1, une hépatite active « auto-immune like » avec hépatite d’interface modérée lymphocytaire et plus rarement plasmocytaire et nécrose lobulaire lympho-histiocytaire focale ou confluente. Dans tous les cas, l’infiltrat lymphocytaire est majoritairement T CD8+.

De plus, la possibilité d’une évolution fibrosante est rapportée dans un délai médian de 5 semaines (1-49) post traitement, se traduisant par la présence d’une fibrose au minimum portale dans 50% des biopsies ; une aggravation de la fibrose est objectivée sur deux biopsies successives d’un patient, parallèlement à une aggravation de l’activité péri-portale.
La corticothérapie a été utilisée chez 10 patients, dont les biopsies montraient une activité nécrotico-inflammatoire A3, les 6 autres ayant évolué favorablement à l’arrêt du traitement. Deux tentatives de ré-introduction ont été effectuées avec succès.
En conclusion : chez des patients recevant au stade métastatique une immunothérapie par inhibiteurs des PCI, la survenue d’une hépatite aigue sévère (grades 3-4) liée à l’administration de ces drogues connues pour modifier l’équilibre du système immunitaire, est rare, même en combinaison. Les lésions histologiques hépatiques dues à la toxicité de ces médicaments sont mieux connues ; certains aspects « AI like » ou « granulomateux » permettent d’orienter vers un type d’inhibiteurs et peuvent apporter des éléments de discussion dans le diagnostic différentiel des hépatites aigues. La possibilité d’une évolution chronique peut justifier la réalisation d’une biopsie hépatique. Enfin, le traitement de ces hépatites médicamenteuses ne nécessite pas toujours l’utilisation de corticothérapie, qui pourrait être réservée à des hépatites aigues sévères avec ictère, insuffisance hépatique aigue et/ou activité histologique A3, permettant une prise en charge personnalisée.
Références bibliographiques :
Zarrabi E et al. Oncology 2018. 94:259–273 ; Larkin J et al. NEJM 2015. 373:23-34 ; Ribas A et al. NEJM 2013. 368:1365-1366 ; Spengler EK et al. Hepatology 2017. 65:745-748

