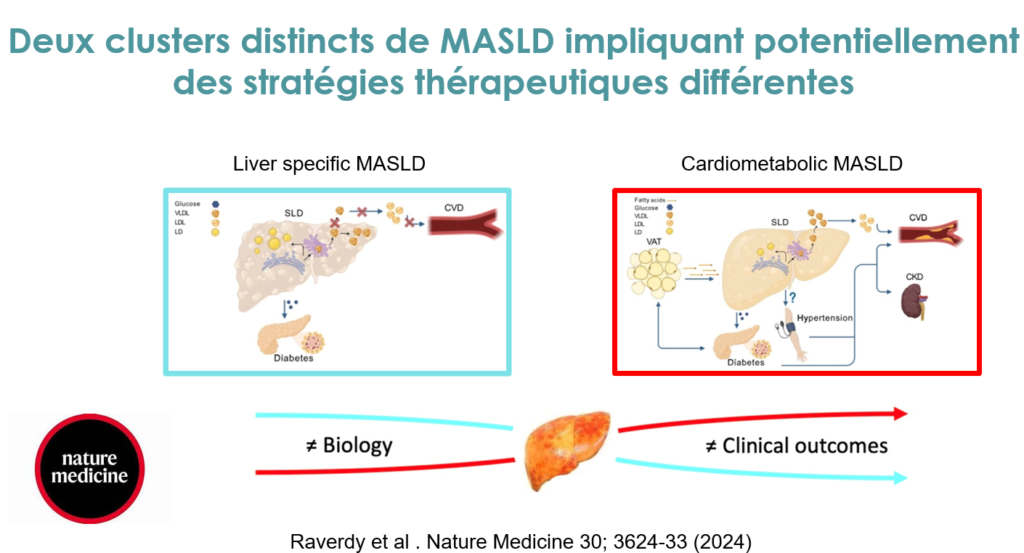
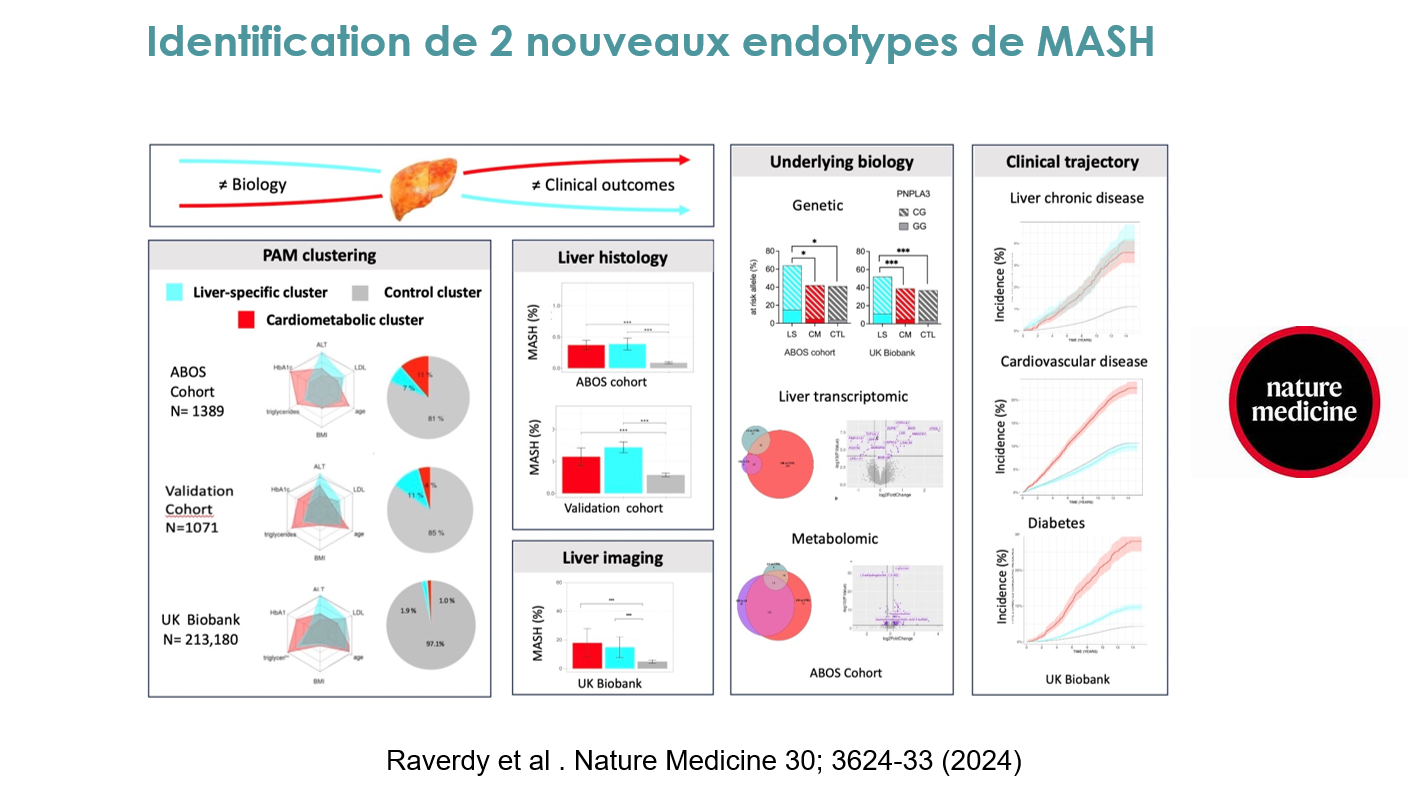
Les travaux menés dans le cadre du RHU Precinash par les équipes lilloises des Pr. François PATTOU, Philippe MATHURIN, et Bart STAELS, en collaboration avec l’Inria et le Karolinska Institute, ont permis de révéler deux clusters distincts de maladie hépatique stéatosique associée à un dysfonctionnement métabolique (Metabolic dysfunction–Associated Liver Disease, MASLD): le cluster cardiométabolique et le cluster spécifique au foie. Bien qu’ils partagent un phénotype hépatique sévère, ces deux clusters diffèrent par leurs mécanismes biologiques, leurs trajectoires cliniques et leurs implications thérapeutiques. Les deux clusters ont été identifiés grâce à un algorithme simple basé sur six paramètres courants : âge, IMC, HbA1c, ALAT, cholestérol LDL et triglycérides. Les clusters ont été validés dans plusieurs cohortes indépendantes et bien caractérisées, démontrant leur robustesse. Aucun des deux clusters ne pouvait être distingué par des analyses histologiques ou par IRM, malgré des différences claires dans les trajectoires cliniques et les profils biologiques. Le cluster cardiométabolique est associé à une prévalence élevée de dyslipidémie, d’hypertension et de dysglycémie, avec un risque accru de développer des maladies cardiovasculaires et un diabète de type 2.
Sur le plan biologique, ce cluster présente un profil métabolomique spécifique incluant des métabolites liés à la dysglycémie, tels que les glycéro-phospholipides, sphingolipides et acides biliaires. Les métabolites microbiotiques identifiés sont associés à la résistance à l’insuline et à une toxicité cardiovasculaire. Les analyses transcriptomiques révèlent également une activation de voies impliquant le transport lipidique, l’inflammation et la fonction vasculaire. Le cluster spécifique au foie est quant à lui caractérisé par des enzymes hépatiques plus élevées, un âge plus jeune, et un faible risque de progression vers le diabète de type 2 ou les maladies cardiovasculaires. Ce cluster présente une forte association génétique avec le variant PNPLA3 rs738409 et un score de risque polygénique élevé pour l’accumulation de lipides dans le foie (gènes du métabolisme lipidique). Les altérations métaboliques observées sont principalement confinées aux hépatocytes, notamment dans le métabolisme lipidique intracellulaire.
Cette étude est très importante car la stratification en clusters basée sur six biomarqueurs dépasse les performances des biomarqueurs individuels, tels que l’ALAT pour les maladies hépatiques ou l’HbA1c pour les maladies cardiovasculaires et le diabète. Des ajustements ont permis de mieux comprendre les interactions entre les biomarqueurs. Par exemple, après ajustement pour l’ALAT, le risque de maladies hépatiques diminue dans le cluster spécifique au foie mais reste élevé dans le cluster cardiométabolique. De même, après ajustement pour l’HbA1c, le risque cardiovasculaire associé au cluster cardiométabolique est réduit, mettant en évidence l’importance d’intégrer plusieurs biomarqueurs dans l’évaluation des risques. Cette stratification ouvre la voie à des traitements personnalisés. En effet, le cluster spécifique au foie pourrait bénéficier du traitement par le Resmétirom, un agoniste des récepteurs de l’hormone thyroïdienne, qui réduit les lipides intra-hépatiques et l’inflammation. Le cluster cardiométabolique pourrait bénéficier d’agents agissant sur le métabolisme lipidique et glucidique, ou de traitements favorisant la perte de poids et la réduction du risque cardiovasculaire, comme les analogues du FGF21 (Pegozafermin, Efruxifermine), les agonistes du PPAR (Lanifibranor) ou les agonistes des récepteurs GLP1 (Sémaglutide, Tirzepatide, Survodutide). L’approche de clustering “dur”, qui attribue chaque individu à un seul cluster, ignore la variabilité intra-cluster. Des approches alternatives, comme le clustering probabiliste ou l’intégration de techniques de réduction dimensionnelle plus avancées, pourraient permettre une analyse plus nuancée des sous-groupes.
Ces découvertes importantes soulignent la nécessité d’approches thérapeutiques personnalisées adaptées aux différents mécanismes biologiques impliqués dans la MASLD pour chaque patient. Elles mettent également en avant l’importance de stratifications basées sur des biomarqueurs simples mais robustes pour guider la prévention et les traitements. Des études prospectives futures seront essentielles pour confirmer la valeur clinique de cette stratification et affiner les interventions thérapeutiques adaptées à chaque profil biologique.